Выбранные химические элементы и их свойства
Азот (N, лат. Азотий ) является неметаллическим химическим элементом, принадлежащим к группе VA. Он содержит 7 протонов в ядре и его атомная масса составляет 14.01. Азот существует в газообразном состоянии, создавая двухатомные молекулы N2, связанные тройной связью. Это бесцветное вещество без запаха, кипящее при 77,35 К (-195,8 ° С) и затвердевающее при 63,14 К (-210,01 ° С) с плотностью 1,2506 г / дм3.
В природе азот встречается в основном в атмосфере, а также в некоторых минералах. Наиболее распространенным из них является нитрат натрия, так называемый Чилийская селитра. Азот из атмосферы, под воздействием космического излучения, распадается на радиоактивный изотоп углерода 14C, который используется для определения возраста горных пород (датировка). Азот также встречается в органических соединениях, таких как аминокислоты и белок ,
В технических целях азот получают фракционной перегонкой жидкого воздуха или сжиганием метана в воздухе, а в лабораторных целях - разложением нитрита аммония или азида натрия.
Азот является нереакционноспособным элементом, только при высоких температурах он может реагировать, например, с некоторыми металлами: алюминием (AlN), магнием (Mg3N2), литием (Li3N) и т. Д. Продукты этих реакций называются нитридами. Во время реакции азота с водородом образуется аммиак (NH4). Азот обычно возникает при окислении +5, но он также может принимать окисление -3, +1, +2 и +4.
Более реактивная форма азота, так называемая активный азот, образующийся при электрических разрядах в азоте. Активный азот легко реагирует с серой, йодом, фосфором, мышьяком, углеводородами и многими металлами.
В реакциях с кислородом азот образует пять типов оксидов:
- закись азота, N2O - бесцветный инертный газ, катализирующий горение;
- оксид азота, NO - парамагнитный газ, очень реактивный;
- Диоксид триоксида, N2O3 - синяя жидкость, стабильная при температуре ниже -10 ° С;
- диоксид азота, NO2 - красно-коричневый газ, сильно ядовит;
- тетраоксид динитрита, N2O4 - бесцветный газ, димер NO2;
- пятиокись диазония, N2O5 - кристаллическое твердое вещество, ангидрид уксусной кислоты;
Азот также образует другие важные соединения, такие как нитраты нитриты, азиды, хлорид аммония, гидразин, гидроксиламин, карбамид, сульфат и карбонат аммония и др.
Азот в основном используется при синтезе аммиака и азотной кислоты, используемых в искусственных удобрениях. Из-за своей низкой реакционной способности он используется в качестве защитного газа в лабораториях и на промышленных предприятиях. Это также используется, чтобы заполнить луковицы и криогенные вещества (жидкий азот).
Сера (S, латинская сера ) - неметаллический элемент, относящийся к группе VIA в периодической таблице элементов, содержит 16 протонов в ядре и его атомная масса 32,07. В настоящее время известно 19 изотопов этого элемента, из которых 4 стабильны. Это происходит в основном в твердом состоянии, температура плавления составляет 115,21 ° C, а плотность составляет 2,07 г / см3.
Сера довольно широко распространена в природе, ее основным источником являются так называемые месторождения. нативная сера. Кроме того, это происходит в вулканических газах и в форме минералов, например, PbS галена, цинковой смеси ZnS, пирита FeS2, пирита меди Cu2S'Fe2S3, гипса CaSO4'2H2O или ангидрита CaSO4. Сера также является компонентом многих органических соединений, например цистеина и метионина, многих пептидов, белков, витаминов и других.
Сера в природе встречается в виде нескольких разновидностей. Наиболее важными из них являются ромбовидная форма a (Sa, желтое кристаллическое твердое вещество с алмазной структурой, состоящее из восьмиоктановых колец - октазиарки, температура плавления которого хорошо растворяется в CS2), моноклинная сера b (Sb, светло-желтый, кристаллическое твердое вещество с моноклинной структурой, изготовлены из октасиарки, температура прохождения Sa 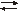 Sb составляет 95,5 ° С; хорошо растворим в CS2), желтая сера (очень подвижная жидкость, стабильная при 119 - 160 ° C, изготовлена из октасиарки и восьмиатомных цепей), катена - полисиарка (Sm, жидкое, красно-коричневое и очень вязкое вещество, состоящее из спиральных цепочек серы максимальная вязкость примерно при 200 ° С), пластичная сера (переохлажденный полисульфид, очень эластичный) и аморфная сера (так называемый сульфатный цветок, аморфный, бледно-желтый порошок, образованный конденсацией паров серы, плохо растворимых в органических соединениях).
Sb составляет 95,5 ° С; хорошо растворим в CS2), желтая сера (очень подвижная жидкость, стабильная при 119 - 160 ° C, изготовлена из октасиарки и восьмиатомных цепей), катена - полисиарка (Sm, жидкое, красно-коричневое и очень вязкое вещество, состоящее из спиральных цепочек серы максимальная вязкость примерно при 200 ° С), пластичная сера (переохлажденный полисульфид, очень эластичный) и аморфная сера (так называемый сульфатный цветок, аморфный, бледно-желтый порошок, образованный конденсацией паров серы, плохо растворимых в органических соединениях).
Сера в соединениях встречается при окислительных состояниях -1, -2, +2, +4 или + 5. Это реактивный элемент, при комнатной температуре он соединяется с фторидом с образованием SF6, при высоких температурах реагирует с кислородом с образованием SO2, с хлором - SCl2 и SCl4, с азотной кислотой - H2SO4. При сильном нагревании он реагирует с водородом и водяным паром, образуя H2S, SO2 или H2SO4 соответственно. Сера также реагирует с металлами (Na, Hg, Fe, Cu и т. Д.) И неметаллами (P, C), образуя сульфиды (например, Na2S, HgS, FeS, CuS, P4S5, CS2), а также с некоторыми органическими соединениями. В растворах, содержащих S2-анионы, он образует полианионы. Другими важными соединениями серы являются S2O, SO3, серные кислоты и их соли, SOCl2, SO2Cl3 и т. Д.
Основными источниками промышленной серы являются природные месторождения. Годовое мировое производство этого элемента в 1994 году составило 49 миллионов. тонн, из которых 19,1% принадлежали США, 14,6% Канаде, 10% Китаю и 6% Польше. С точки зрения природных ресурсов серы Польша находится на переднем крае мира - месторождения в нашей стране оцениваются примерно в 747 миллионов. общий тон (данные за 1994 год). Крупнейшие ресурсы находятся в непосредственной близости от Тарнобжег, Езёрка и Гржибова. Наша страна также является крупнейшим производителем самородной серы - 35% мирового производства, в том числе против США (28,1%).
Сера используется в производстве серной кислоты и целлюлозы в процессах вулканизации. Он также используется для производства красителей, пластмасс, пестицидов, лекарств и фунгицидов.
Кремний (S, латинский кремний ) - это элемент, относящийся к четвертой основной группе периодической таблицы, который считается полуметаллом. Он содержит 14 протонов в ядре, его атомная масса составляет 28.09. Известно 16 изотопов, из которых только три стабильны. Это один из самых распространенных элементов в природе, но он присутствует не в чистом виде, а только в многочисленных соединениях. Чистый кремний в форме твердого, хрупкого твердого вещества с алмазной структурой получают восстановлением кремнезема магнием или алюминием или кальцинированием углерода, кремнезема и железа. Кремний плавится при 1417 ° С, а его плотность составляет 2,33 г / см3.
Наиболее важными соединениями кремния являются кремнезем SiO2 (диоксид кремния), силикаты и алюмосиликаты (кремнеземы и их соли), силаны (общей формулы SinH2n + 2), силоксаны (соединения с водородом и кислородом), силикаты (соединения с металлами), фторсилики и карборунд (SiC) ,
Кремний широко используется в промышленности, главным образом для производства электронных систем, для производства стекла и керамики, строительных материалов, моющих средств (пористых алюмосиликатов), силиконовых смазок и т. Д. Соединения кремния также используются в качестве катализаторов во многих важных промышленных процессах.
Уголь (C, латинский carboneum ), принадлежащий к четвертой основной группе периодической таблицы, представляет собой неметаллический элемент с атомным номером 6 и атомной массой 12. Он встречается в 12 изотопных формах, 2 из которых являются стабильными (12C и 13C). В природе оно встречается как в свободном состоянии в виде аллотропных разновидностей: алмаза, графита и аморфного углерода, так и в виде многочисленных соединений. Его основными источниками являются ископаемое топливо, нефть и природный газ, а также многочисленные полезные ископаемые. Фуллерен, не встречающийся в природе, является недавно обнаруженной аллотропной формой углерода. Уголь является биологически важным элементом, вся органическая химия основана на его соединениях, он содержится в живых растительных и животных организмах. Древесный уголь имеет высокую температуру плавления (выше 3550 ° С).
Уголь не является очень реакционноспособным элементом, он содержится в соединениях при степени окисления -4, +2 или +4. Одной из наиболее важных реакций является окисление углерода до CO2 при высоких температурах. Углерод также реагирует с серой, образуя CS2, а также водород, водяной пар и металлы. При комнатной температуре он соединяется с фтором, давая CF4.
Безусловно, наиболее важными углеродными соединениями являются углеводороды и их производные. Другими важными соединениями этого элемента являются четыреххлористый углерод, ХФУ фосген, дисульфид углерода, диоксид углерода и оксид, натриевая вода, гидроксид и карбонат натрия и цианиды.
Уголь имеет принципиальное промышленное значение, он является важнейшим источником энергии (в виде нефтяного топлива, природного газа и каменного угля). Он также используется в качестве восстановителя для приготовления определенных металлов. В качестве радиоактивного индикатора использовали нестабильный изотоп углерода 14 C. Другие углеводородные производные, например полимеры, также имеют важное применение.